Química primeiro ano
Química
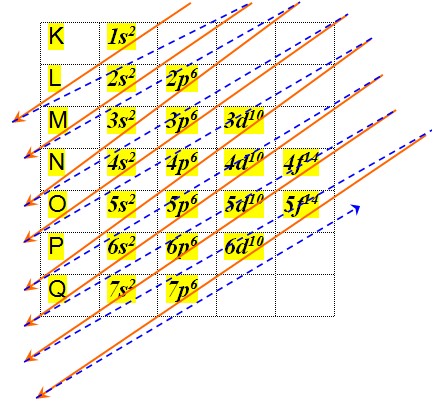
Distribuição Eletrônica por Subníveis:
A distribuição eletrônica mostra como os elétrons se organizam nos átomos, ocupando níveis e subníveis de energia. Essa organização influencia as propriedades químicas dos elementos.
Níveis e Subníveis: Imagine camadas em torno do núcleo, cada uma com um nível de energia. Dentro dessas camadas, há subníveis (s, p, d, f) com diferentes formas. Os elétrons preenchem os subníveis em ordem crescente de energia, seguindo o diagrama de Pauling.
Distribuição eletrônica:
A distribuição eletrônica é como um mapa que mostra onde os elétrons de um átomo estão localizados. Os elétrons se organizam em camadas, que são como "cascas" concêntricas ao redor do núcleo. Cada camada pode acomodar um número máximo de elétrons. A primeira camada, a mais próxima do núcleo, é a mais "cheia" de energia. À medida que nos afastamos do núcleo, as camadas têm mais energia.
Então, surgiram as 7 camadas eletrônicas (K, L, M, N, O, P e Q), as quais são representadas pelas linhas horizontais numeradas de 1 a 7 na tabela periódica.A eletrosfera
A eletrosfera é a região ao redor do núcleo atômico onde os elétrons se movimentam. Esses elétrons, partículas com carga negativa, orbitam o núcleo e determinam as propriedades químicas dos elementos.
Descobertos por J.J. Thomson em 1897, os elétrons são fundamentais para a formação das ligações químicas. Ao se transferirem ou serem compartilhados entre átomos, os elétrons permitem a formação de moléculas e compostos.
É importante ressaltar que a representação da eletrosfera é um modelo simplificado. A maior parte do átomo é espaço vazio. Imagine um átomo de hidrogênio: se o núcleo fosse do tamanho de uma bola de tênis, o elétron estaria a cerca de três quilômetros de distância! A eletrosfera é, portanto, muito maior que o núcleo.
A eletrosfera é a região onde se concentra a atividade química do átomo, sendo essencial para a compreensão da matéria.
N.I. 28/5/24 Isóbaros, Isótonos e Isótopos
Isóbaros
Isóbaros são átomos de diferentes elementos com o mesmo número de massa (A), mas diferentes números atômicos (Z). Eles têm o mesmo total de prótons e nêutrons somados.
**Exemplo:**
Isótonos
Isótonos são átomos de diferentes elementos com o mesmo número de nêutrons (N), mas diferentes números de prótons (Z).
**Exemplo:**
.
Isótopos
Isótopos são átomos do mesmo elemento com o mesmo número de prótons (Z), mas diferentes números de nêutrons (N).
**Exemplo:**
Cálculo de numero de partículas atômicas
"O cálculo do número de partículas atômicas é utilizado para indicar a quantidade de prótons (no núcleo), elétrons (na eletrosfera) e nêutrons (no núcleo) presentes em um átomo ou íon qualquer. Para realizá-lo, é fundamental conhecer algumas características dos átomos:
1- Número atômico (Z)
É um código matemático, representado pela letra Z maiúscula, posicionado no lado esquerdo inferior da sigla de um átomo:"
"Ele indica a quantidade de prótons (p) no núcleo e a quantidade de elétrons (e) na eletrosfera de um átomo. Assim, em termos gerais:"
Z= P =E
2- Número de massa (A)
É um código matemático que corresponde à soma do número de prótons (p) e de nêutrons (n), ambos presentes no núcleo de um átomo qualquer. A equação que representa o número de massa é dada por:
A = p + n
Como o número de prótons é igual ao número atômico, podemos escrever a equação para calcular o número de massa da seguinte forma:
A = Z + n
Se conhecemos o número de massa e o número atômico de um átomo, podemos determinar o número de nêutrons da seguinte maneira:
n = A – Z
3- Íons
São átomos que perdem ou ganham elétrons. Apresentam um sinal positivo ou negativo posicionado na parte superior direita da sua representação, como no modelo a seguir:
X+ ou X-
Íon positivo: é denominado de cátion e o sinal positivo indica que ele perdeu elétrons.
Íon negativo: é denominado de ânion e o sinal negativo indica que ele ganhou elétrons."
N.I 26/03/2024
Atomística
A atomística estuda tudo relacionado ao átomo, desde a sua estrutura e como as partículas subatômicas estão nele distribuídas até as semelhanças existentes entre os átomos.
"Estrutura do átomo
O átomo é dividido em núcleo, onde encontram-se os prótons e os nêutrons, e a eletrosfera, onde estão os elétrons.
O modelo atual do átomo propõe que ele esteja dividido em duas regiões principais: o núcleo, em que estão concentradas as partículas positivas ou prótons, e os nêutrons, que são partículas sem carga necessárias para dar estabilidade ao núcleo. Ainda há a eletrosfera, região onde os elétrons orbitam ao redor do núcleo."
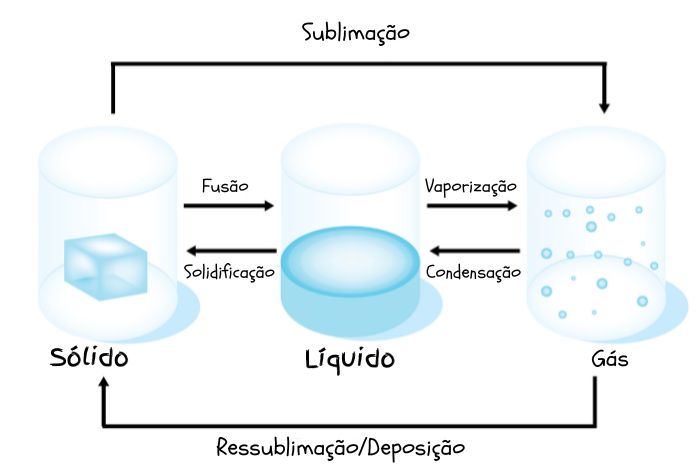
Estados físicos da matéria
"As condições físicas da matéria são determinadas pela distância entre as moléculas, conexões moleculares e pela energia cinética que impulsiona as partículas de uma amostra. Esses estados são:
1. Sólido
2. Líquido
3. Gasoso
4. Plasma
5. Condensado de Bose-Einstein
No estado sólido, as moléculas estão densamente agrupadas e apresentam movimentação reduzida. Por outro lado, nos estados gasoso e plasma, as moléculas estão espaçadas e possuem uma elevada energia cinética. Os materiais no estado líquido ocupam uma posição intermediária, não mantêm uma forma física definida, exibem maior energia cinética que os materiais sólidos e têm um espaçamento molecular menor do que os materiais gasosos."


.jpg)
Nenhum comentário:
Postar um comentário
Observação: somente um membro deste blog pode postar um comentário.